En Bioquímica se define como la concentración de iones de hidrogeno en estado estándar es 10 -7 M, porque el pH fisiológico es aproximadamente 7. En consecuencia, el cambio en la energía estándar de Gibss de acuerdos con estas dos convenciones será diferente para reacciones que comprenden la toma o liberación de iones de hidrógeno, lo cual dependerá de la convención que se utilice.
La energía libre de Gibbs
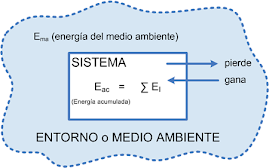
La segunda ley de la termodinámica indica que una reacción espontanea hace que la entropía del universo se incremente; es decir: ΔSuniverso> 0.
Para determinar el signo de ΔSuniverso cuando ocurre la reacción es necesario calcular tanto ΔSsistema como ΔSalrededores.
Sin embargo, por lo general sólo nos interesa lo que ocurre en un sistema en particular. Por esta razón es deseable tener otra función termodinámica que ayude a determinar si una reacción ocurrirá espontáneamente si sólo se considera al sistema mismo.
La ecuación que se obtiene, para establecer que un proceso se lleve a cabo a presión constante y temperatura T:
ΔGsistema = ΔHsistema - ΔSsistema
A fin de determinar la espontaneidad de una reacción de una manera más directa, se utiliza otra función termodinámica: Energía Libre de Gibbs, o sólo energía libre:
G=T-TS
Todas las cantidades de la ecuación son propiedades del sistema, y T es su temperatura. G tendrá unidades de energía (tanto H como TS también) Igual que H y S, G es una función de estado.
El cambio de energía libre de un sistema para un proceso a temperatura constante es:
ΔG=ΔH –TΔS
Entonces, la energía libre es la energía disponible para realizar un trabajo. Así, si en una reacción particular se libera energía útil (es decir, si su ΔG es negativo), este hecho, por sí solo, garantiza que la reacción es espontanea, sin importar lo que ocurra en el resto del universo.
Las condiciones para la espontaneidad y el equilibrio a temperatura constante y presión constante en términos de ΔG son:
ΔG < 0….. La reacción es espontanea en la dirección directa.
ΔG>0….. La reacción es no espontánea. La reacción es espontanea en dirección opuesta.
ΔG=0…. El sistema está en equilibrio. No hay un cambio neto.
Nota
*ΔS= Es el cambio de entropía.
* ΔH= Es el cambio de entalpía.
* ΔG= Es el cambio de la energía libre





No hay comentarios:
Publicar un comentario